Konfiguracje ciągłej terapii nerkozastępczej (CRRT)
Różne opcje jako standardowe terapie ostrego uszkodzenia nerek
- Ciągła hemodializa żylno-żylna (CVVHD)
- Ciągła hemofiltracja żylno-żylna (CVVH)
- Ciągła hemodiafiltracja żylno-żylna (CVVHDF)
| Ciągła terapia nerkozastępcza w skrócie |
|---|
| Kontroluje stan płynów pacjenta, umożliwiając delikatne usuwanie płynu |
| Oczyszcza krew pacjenta, stosując roztwór elektrolitu |
| Usuwa toksyny mocznicowe |
| Koryguje zaburzenia elektrolitowe i gospodarki kwasowo-zasadowej |
| Wymaga pozaustrojowego obwodu krwi („dostęp żylno-żylny”) |
| Zwykle jest to ciągła terapia, ale może być przerwana – na przykład z powodu zmian worka i filtra, operacji chirurgicznej, tomografii komputerowej itp. |
Korzystne warianty CRRT: CVVHD i postdylucyjna CVVHDF
- CVVHD i post-CVVHDF umożliwiają efektywne wykorzystanie płynu do CRRT. Każda predylucja rozcieńczenia toksyny mocznicowe i zmniejsza efektywność stosowanego płynu do CRRT
- Minimalna lub ograniczona hemokoncentracja w CVVHD i post- CVVHDF przyczynia się do zwiększenia efektywności filtra. CCzysta post-CVVH wymagałaby dużych przepływów krwi w celu ograniczenia hemokoncentracji, co w praktyce może być trudne do zrealizowania
multiFiltrate Ci-Ca® EMiC®2
Gdy łączy się Ci-Ca® i EMiC®2 pacjent korzysta zarówno z ustalonego protokołu CVVHD Ci-Ca, jak również zwiększonego klirensu średnich cząsteczek.
Więcej informacji, patrz filtry do CRRT i plazmaferezy
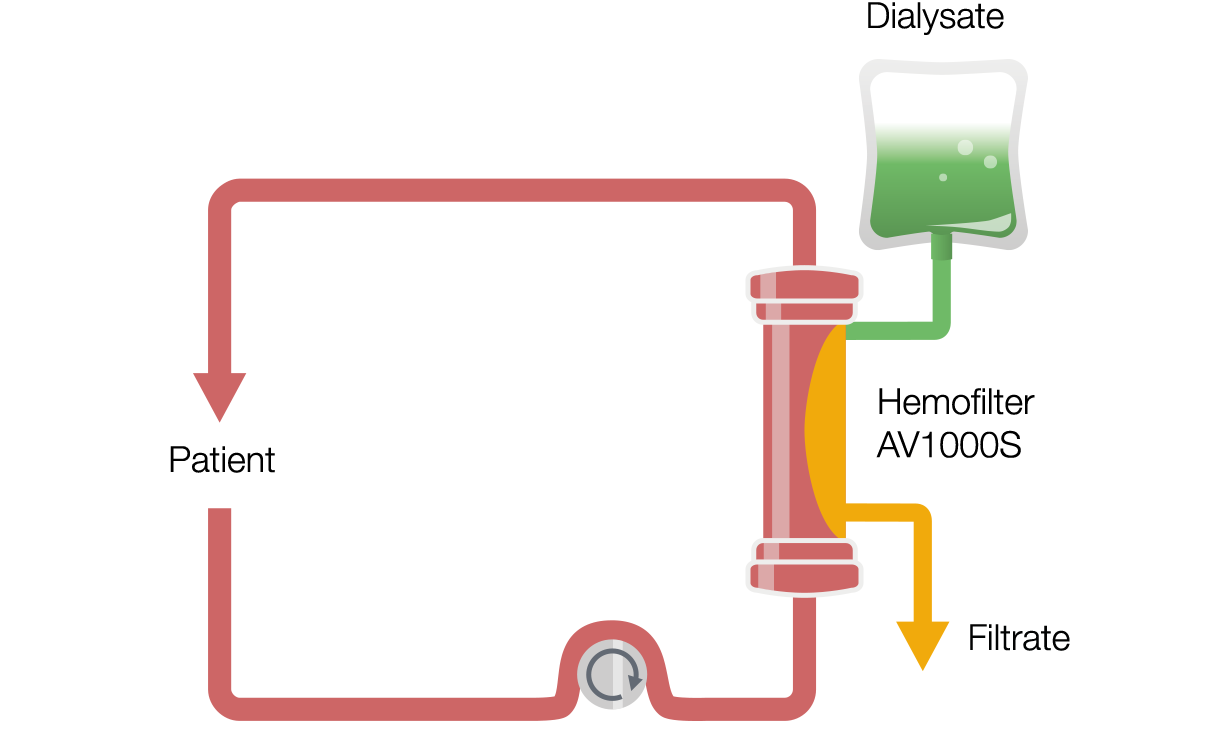
Ciągła hemodializa żylno-żylna (CVVHD)
CVVHD to terapia oparta na dyfuzji. Krew podawana przez pompę przepływa przez przedział krwi filtra, a dializat przepływa w przedziale dializatu w kierunku przeciwnym. Przepływ przeciwprądowy zwiększa gradient dyfuzji, a tym samym wynikające z niej klirensy. W przypadku CVVHD przepływ dializatu jest wyraźnie mniejszy niż przepływ krwi, co odpowiada klirensom ściśle związanym z przepływem dializatu.
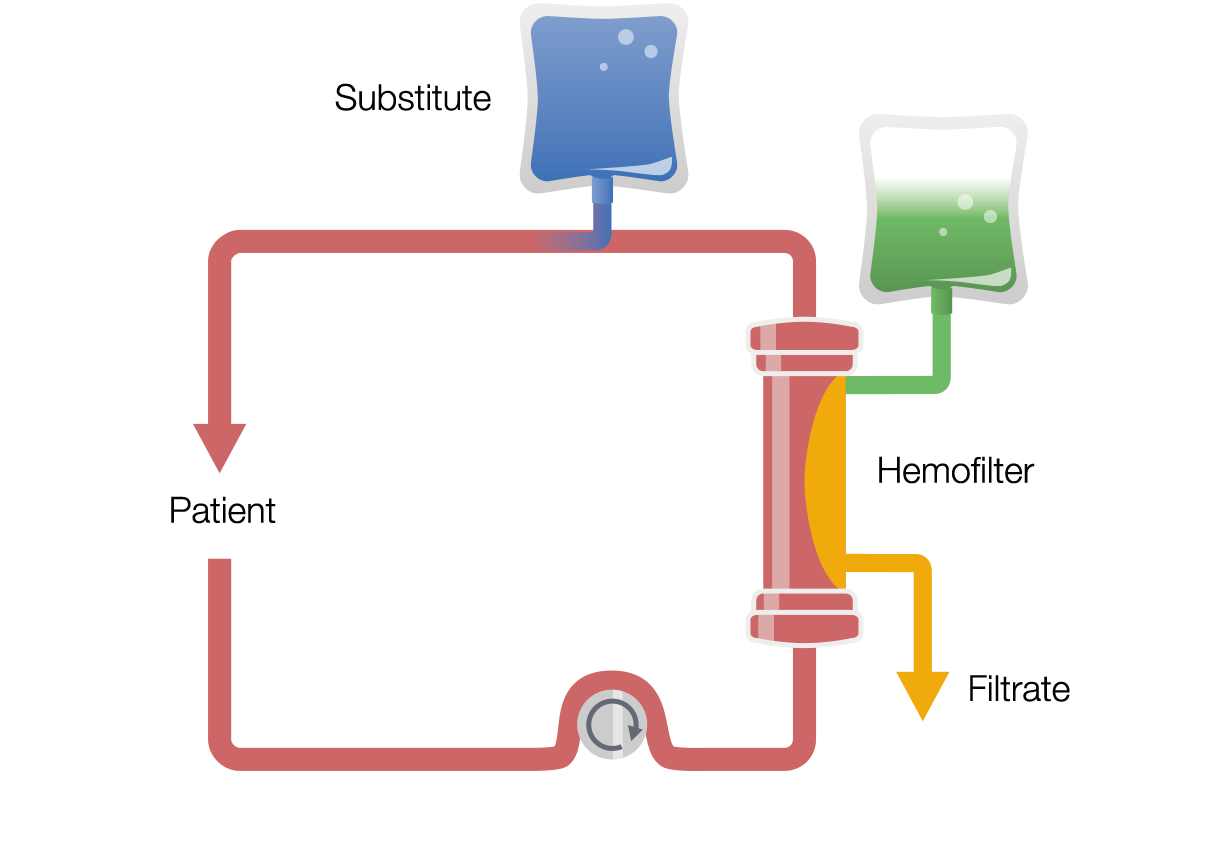
Ciągła hemofiltracja żylno-żylna (CVVH)
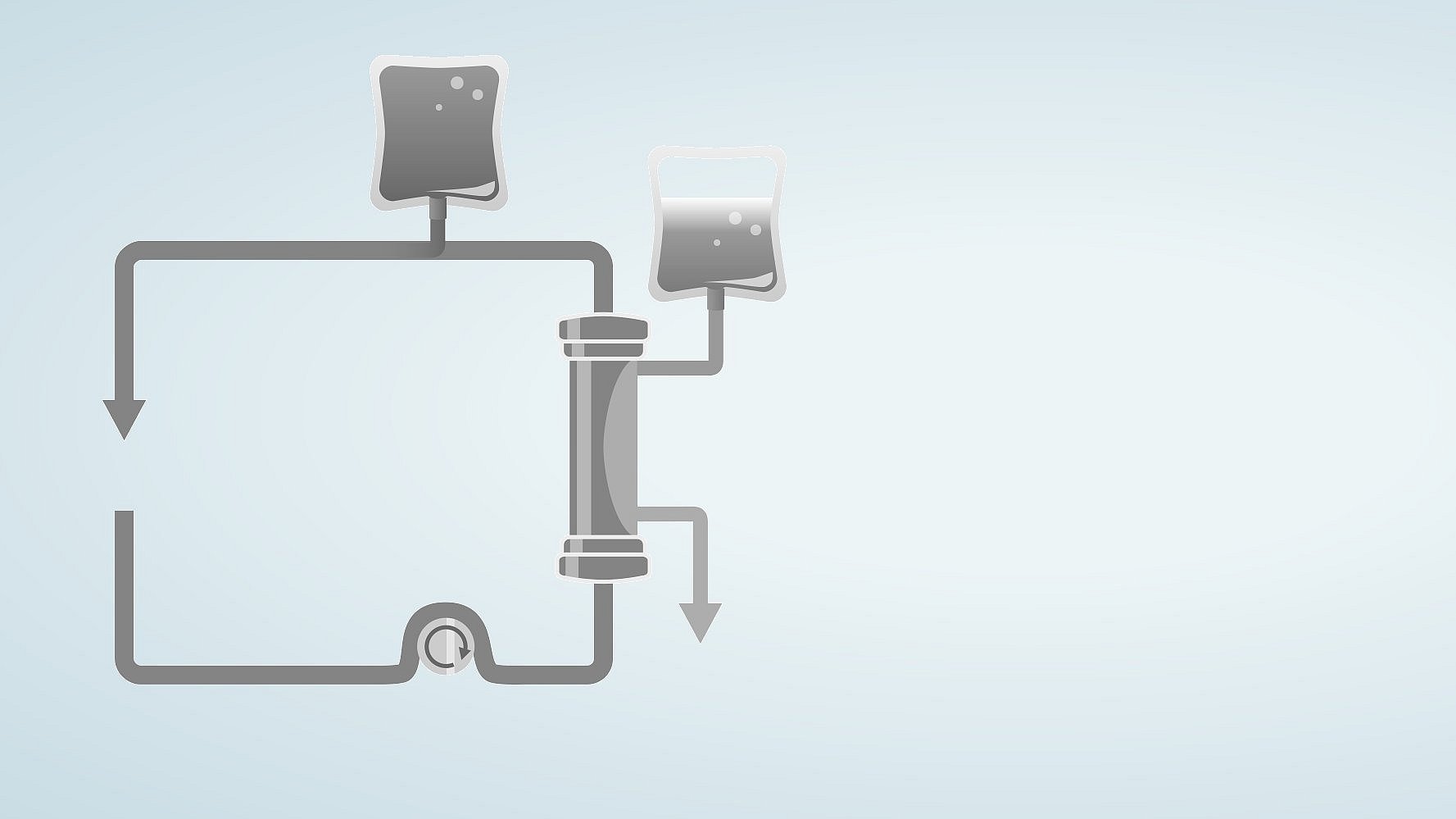
CVVHD to terapia oparta na konwekcji. Krew jest pompowana i przepływa przez przedział krwi, a pompa filtratu powoduje znaczny przepływ filtratu. TTen przepływ filtratu wymaga kompensacji przez wlew płynu substytucyjnego do obiegu krwi, przed lub za filtrem. W ten sposób można wytworzyć wysoki przepływ filtratu, co zwiększa usuwanie substancji rozpuszczonych.
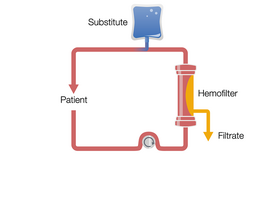
Ciągła hemofiltracja żylno-żylna w późniejszym rozcieńczeniu (po CVVH)
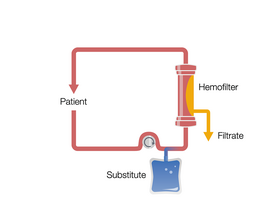
Ciągła hemofiltracja żylno-żylna w rozcieńczeniu wstępnym (przed CVVH)
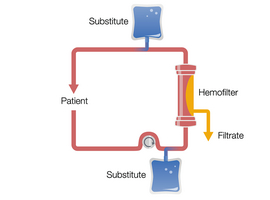
Ciągła hemofiltracja żylno-żylna w stanie przed i po rozcieńczeniu (przed i po CVVH)
Ciągła hemodiafiltracja żylno-żylna (CVVHDF)
CVVHDF łączy dwa typy terapii - dyfuzyjną i konwekcyjną. Krew podawana przez pompę przepływa przez przedział krwi filtra, a dializat przepływa w przedziale dializatu w kierunku przeciwnym. Przepływ przeciwprądowy zwiększa gradient dyfuzji, a tym samym wynikające z niej klirensy. Ponadto do krwiobiegu podawany jest płyn substytucyjny, przed lub za filtrem. Równocześnie następuje filtracja wody przez błonę, w wyniku czego powstaje klirens konwekcyjny.
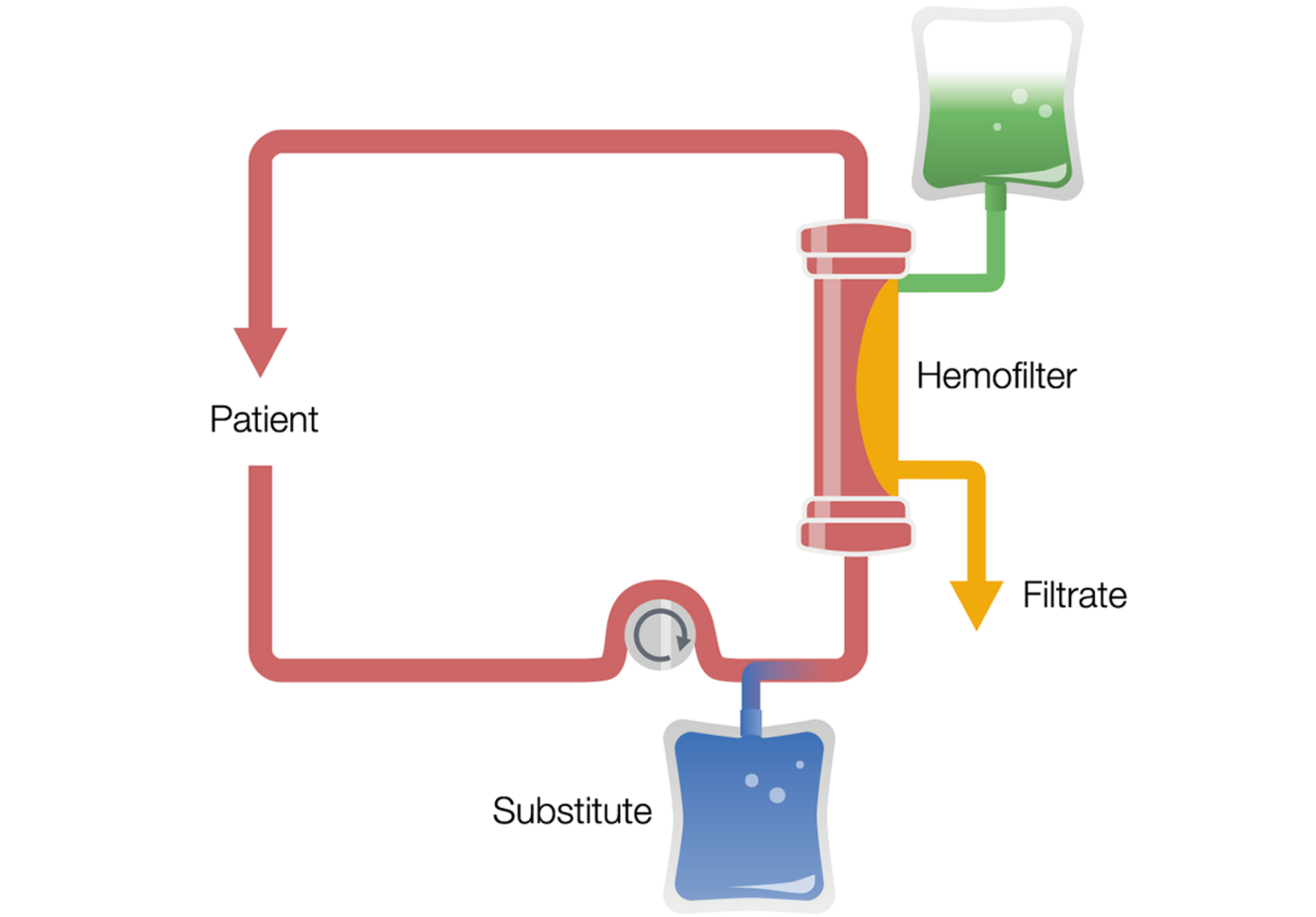
Ciągła hemodiafiltracja żylno-żylna z predylucją (pre-CVVHDF)
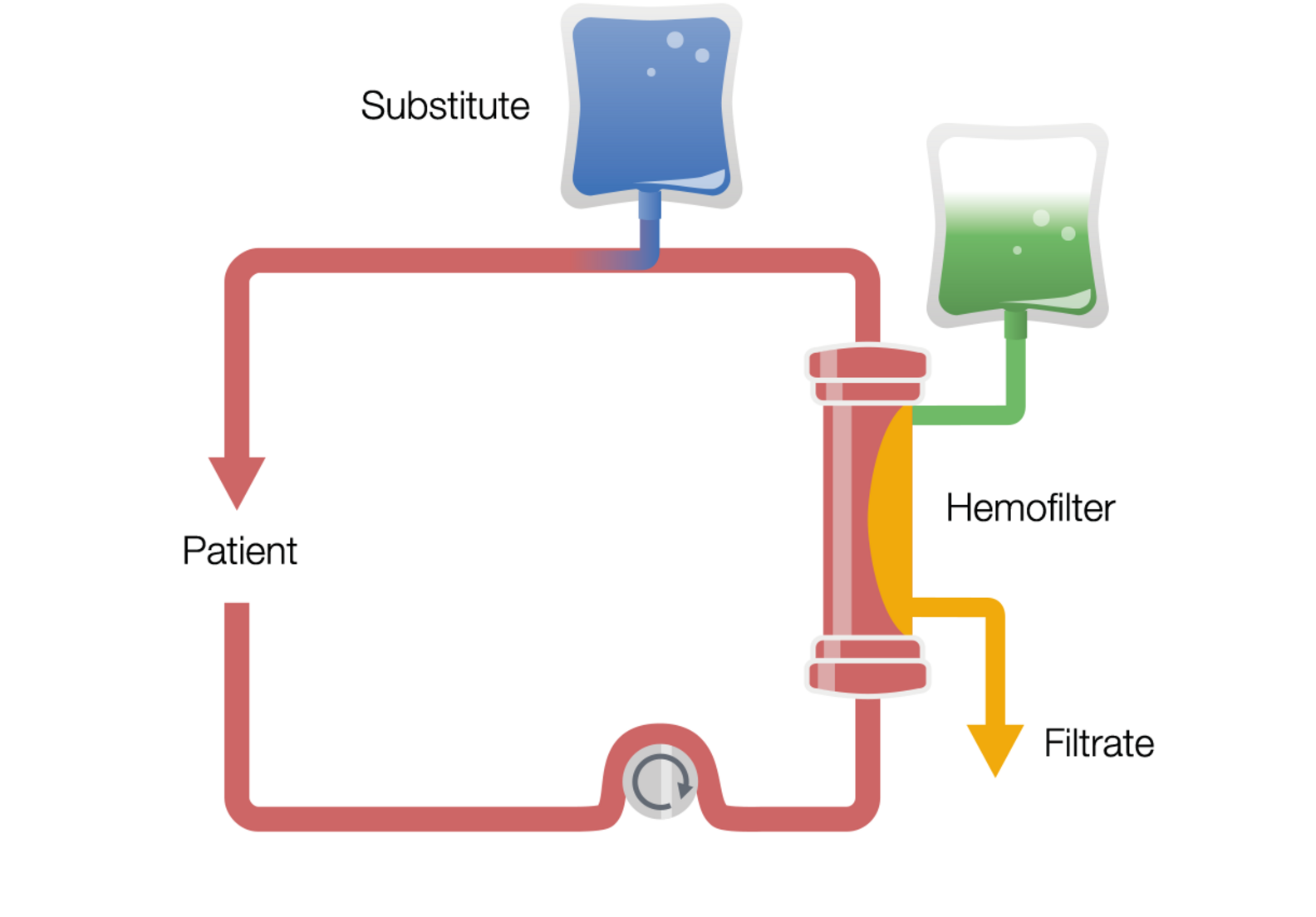
Ciągła hemodiafiltracja żylno-żylna z postdylucją (post-CVVHDF)
CRRT w porównaniu do iHD (przerywanej hemodializy)
Terapia nerkozastępcza (RRT) w leczeniu ostrego uszkodzenia nerek (AKI) jest najczęściej realizowana jako pozaustrojowe oczyszczanie krwi. Spośród pozaustrojowych metod oczyszczania krwi, w leczeniu AKI stosowane są głównie CRRT i przerywana hemodializa (iHD). Przerywana hemodializa oznacza zastosowanie RRT, ponieważ jest ona inaczej stosowana u pacjentów poddawanych przewlekłej dializie, w której czas trwania zabiegu wynosi np. 4 godziny.
SLEDD
Oprócz CRRT i iHD w niektórych ośrodkach stosowane są również terapie hybrydowe. Takie hybrydowe terapie charakteryzują się:
- Dłuższym czasem trwania terapii (np. 8 do 12 godzin na sesję), co pozwala na niższy przepływ krwi i dializatu.
- Codziennym stosowaniem (lub prawie codziennym).
Jedną z terapii hybrydowych jest SLEDD (Slow Extended Daily Dialysis – powolna wydłużona codzienna dializa), która oznacza powolne (czyli o względnie niskich przepływach krwi i dializatu) i wydłużone (czyli o czasie trwania znacznie przekraczającym typowe 4 - 5 godzin iHD) zabiegi dializy wykonywane codziennie.
Z punktu widzenia zarówno skuteczności, jak i tolerancji przez pacjenta, te formy terapii można uznać za pośrednie między CRRT i iHD.
Zalety CRRT i iHD
- Terapia CRRT jest stabilniejsza i łagodniejsza
- Terapia iHD jest szybsza, co powoduje szybsze zmiany u pacjenta
- Wykazano, że CRRT jest lepsza pod względem rokowania powrotu czynności nerek, a także prawdopodobieństwa uniknięcia przewlekłej dializoterapii po AKI
- Dotychczas nie wykazano żadnej różnicy między wskaźnikami śmiertelności obu metod terapii
| Zalety CRRT | Zalety iHD |
|
|
Wiele dużych badań na różnych kontynentach wykazało lepszy powrót czynności nerek w przypadku zastosowania CRRT.1,2,3
Podsumowując wyniki tego i wielu dalszych badań, Schneider i inni stwierdzili w meta-analizie, że pacjenci rozpoczynający leczenie AKI z zastosowaniem przerywanej metody RRT „mieli 1,7-krotnie większe ryzyko, że pozostaną zależni od dializ w porównaniu z tymi, którzy od początku byli leczeni CRRT”4.
Niedawno Wald i inni opublikowali wyniki dotychczas największego badania porównującego wyniki po zastosowaniu CRRT i iHD.5 Badanie to wyraźnie pokazuje, że rozpoczęcie leczenia AKI od CRRT wiąże się ze znacznie lepszym powrotem funkcji nerek i mniejszą częstością występowania stałej zależności od dializy.
Ponieważ koszty niezbędnej później dializy przewlekłej stanowią wielkie obciążenie, Bellomo i Schneider podsumowują w towarzyszącym artykule redakcyjnym: „Ekonomiczny sens zastosowania konwencjonalnej IHD [iHD zamiast CRRT] zniknął, ponieważ w badaniu Wald i in. ujawniono rzeczywisty koszt IHD ”.6
Oprócz czysto ekonomicznych ocen, unikanie konieczności przewlekłej dializy po epizodzie AKI jest ważnym celem medycznym i etycznym, zważywszy na duże obciążenie pacjenta związane ze stałą dializą, i tym samym dodatkowo wspiera wybór CRRT jako początkowego sposobu leczenia AKI.
1 Bell M. i in., Intensive Care Medicine (2007); 33: 773-780
2 Uchino i in., The International journal of Artificial Organs (2007); 30: 281-292
3 Lin Y.F. i in., The American Journal of Surgery (2009); 198: 325-332
4 Schneider A.G. i in., Intensive Care Medicine (2013); 39: 987-997
5 Wald R. i in., Critical Care Medicine (2014); 42: 868-876
6 Bellomo R. i Schneider A.G., Critical Care Medicine (2014); 42: 990-991